纳米缓释型CO供体SMA/CORM2通过调控巨噬细胞重编程抑制博来霉素诱导的肺纤维化
近期,安徽医科大学与日本崇城大学方军教授团队在《Journal of Controlled Release》期刊2022年第341期上以题为“Nano-designed CO donor ameliorates bleomycin-induced pulmonary fibrosis via macrophage manipulation”发表研究性论文。
特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)是一种常见的慢性、进行性和不可逆的肺间质性疾病[1]。IPF的发生发展伴随慢性炎症反应和进行性组织修复,最终发展为不可逆的肺部瘢痕和气道重塑[2]。但目前IPF的具体发病机制未完全阐明。IPF预后差,诊断后中位生存期约2-4年,但迄今为止治疗方法有限。因此,目前非常有必要研究出IPF的机制和靶点,及针对靶点的治疗策略。
该团队基于炎症组织的高渗透长滞留(enhanced permeability and retention, EPR)效应开发了一种靶向性的抗炎气体分子CO聚合物胶束给药系统,即纳米缓释型CO供体SMA/CORM2。SMA/CORM2可靶向递送至病变组织,具有水溶性大、缓释和控释的特性[3]。课题组前期研究结果发现SMA/CORM2对炎症性疾病,如:右旋糖酐硫酸钠诱导的小鼠结肠炎和对乙酰氨基酚诱导的急性肝损伤,具有治疗作用[3, 4]。进而,该团队进一步研究了SMA/CORM2对IPF的作用。
该团通过博来霉素(bleomycin, BLM)诱导的小鼠IPF模型探讨了SMA/CORM2对间质性肺纤维化的影响。研究结果发现SMA/CORM2可以靶向递释至受损肺组织,逆转BLM诱导的IPF。进而该团队研究了IPF发生发展的经典途径,即TGF-β/Smad2/3信号通路调控EMT。研究结果发现SMA/CORM2通过TGF-β/Smad2/3信号通路调控EMT抑制IPF(图1)。
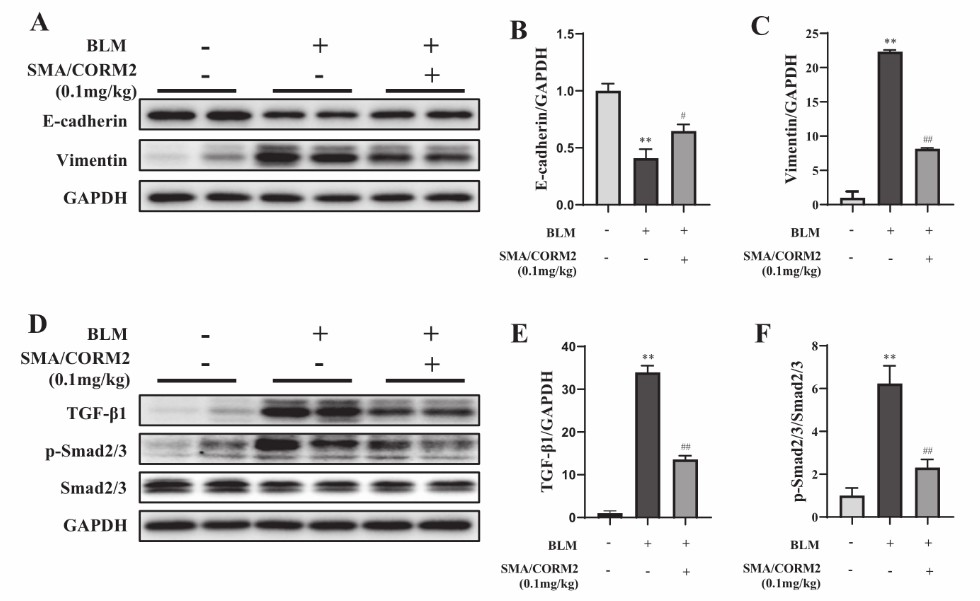
图1. Western blotting检测小鼠肺组织EMT和TGF-β/Smad2/3信号通路的表达水平,包括E-cadherin(A, B)和Vimentin(A, C)、TGF-β1(D, E)、p-Smad2/3和Smad2/3(D, F)
巨噬细胞代谢重编程,以前也称巨噬细胞极化,是巨噬细胞执行功能的重要途径。巨噬细胞重编程有两种结果,即促炎巨噬细胞和抗炎巨噬细胞。抗炎巨噬细胞(CD206+样巨噬细胞)分泌的TGF-β1抗炎因子是调控纤维化进展的重要细胞因子[5]。因此该团队推测SMA/CORM2抑制巨噬细胞重编程为抗炎表型,从而下调TGF-β/Smad2/3信号通路。进而该团队检测了肺组织中抗炎巨噬细胞生物标志物的表达。研究结果发现SMA/CORM2处理后可抑制BLM引起的抗炎巨噬细胞重编程。此外,有研究表明HO-1是调控巨噬细胞抗炎表型重编程的关键信号因子[6],而HIF-1α是HO-1的上游信号分子[7]。基于此,该团队进一步研究了肺组织HIF-1α/HO-1信号通路的表达水平。研究发现SMA/CORM2处理后HIF-1α/HO-1信号通路表达被抑制。综上,该团队的研究表明SMA/CORM2可通过HIF-1α/HO-1信号通路抑制巨噬细胞抗炎表型重编程,从而调控TGF-β/Smad2/3信号通路抑制IPF(图2)。
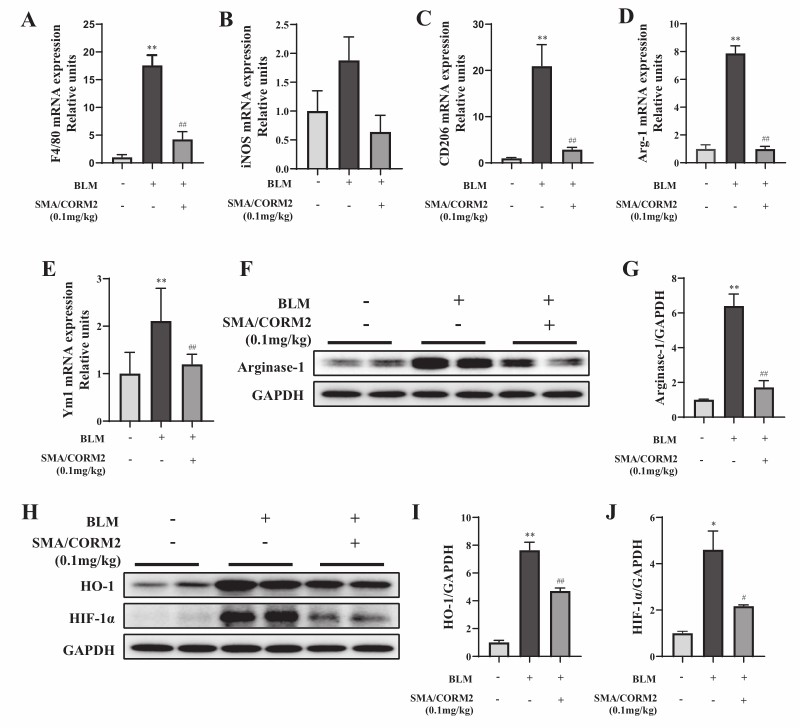
图2. RT-PCR检测巨噬细胞标志物的转录水平,包括总巨噬细胞标志物F4/80(A)、促炎巨噬细胞标志物iNOS(B)、抗炎巨噬细胞标志物CD206(C)、Arg-1(D)和Ym1(E)。Western blotting检测小鼠肺组织抗炎巨噬细胞标志物Arg-1(F, G),与HIF-1α/HO-1信号通路的表达,包括HO-1(H, I)、HIF-1α(H, J)。
为了验证SMA/CORM2中发挥效应的是抗炎气体分子CO,该团队进一步研究了失活SMA/CORM2(iSMA/CORM2)和水解SMA对IPF的作用。结果证实CO作为SMA/CORM2的效应分子抑制BLM诱导的IPF,该效应与聚合物组分无关。同时该团队进一步比较了SMA/CORM2与CO释放分子CORM2的生物利用度。结果发现在CO载量相等的情况下SMA/CORM2相较于CORM2具有更高的生物利用度(图3)。
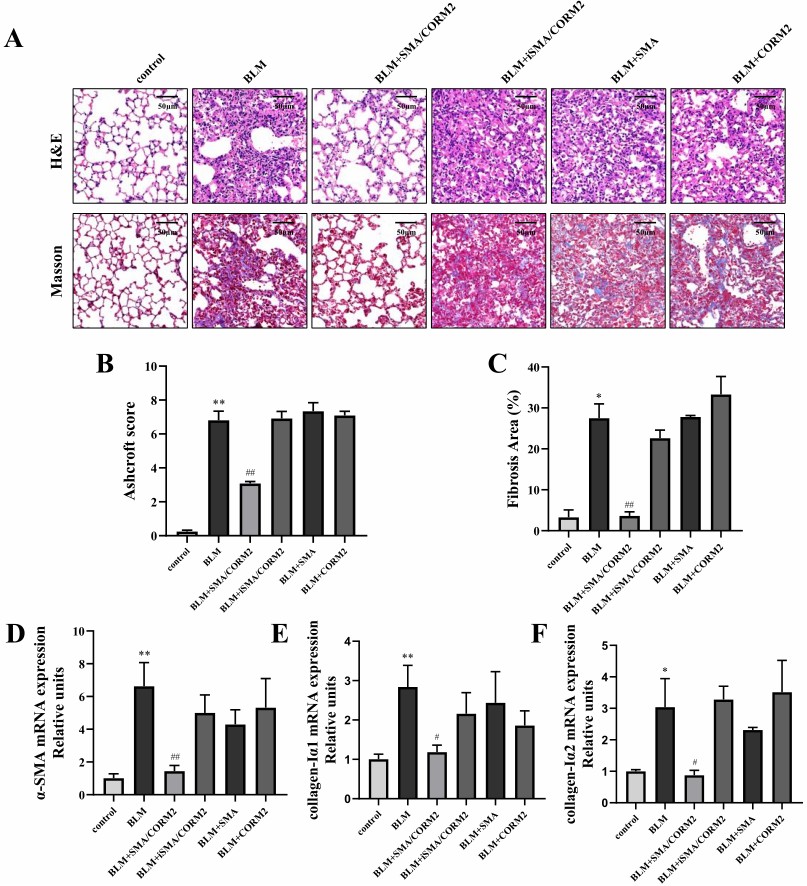
图3. 失活SMA/CORM2(iSMA/CORM2)、水解SMA和CORM2应用于BLM诱导的肺纤维化模型。H&E染色和Masson染色(A)检测肺组织炎症和肺间质纤维化程度,病理Ashcroft评分(B)和纤维化面积%(C)定量评估。RT-PCR检测纤维化标志物的转录水平,包括α-SMA(D)、collagen-Ⅰα1(E)、collagen-Ⅰα2(F)。
最后,为探讨SMA/CORM2治疗IPF在未来的临床应用前景,该团队对SMA/CORM2的安全性进行了评估。安全性评估主要包括小鼠肝肾功能,与健康小鼠应用SMA/CORM2后对肺组织的影响。结果表明,SMA/CORM2对小鼠肝肾功能没有明显影响;在肺组织的检测中也未发现任何肺损伤和纤维化迹象。该项研究结果肯定了SMA/CORM2治疗IPF的安全性(图4)。
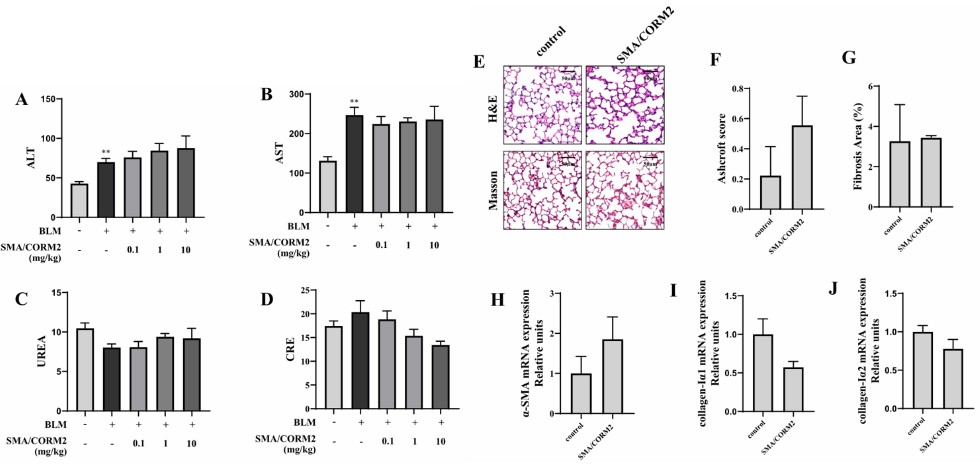
图4 在BLM诱导的肺纤维化模型中应用SMA/CORM2,全自动生化分析仪检测肝肾功能,肝功能评价包括血清ALT(A)和AST(B),肾功能评价包括血清尿素(C)和CRE(D)。对未暴露BLM的健康小鼠应用SMA/CORM2。H&E染色和Masson染色(E)检测肺组织炎症和肺间质纤维化程度,病理Ashcroft评分(F)和纤维化面积%(G)定量评估。RT-PCR检测纤维化标志物的转录水平,包括α-SMA(H)、collagen-Ⅰα1(I)、collagen-Ⅰα2(J)。
结论:在这项研究中,该团队阐明了纳米设计的缓释型CO供体SMA/CORM2对BLM诱导的IPF的保护作用及机制。SMA/CORM2通过调控HIF-1α/HO-1信号通路抑制肺间质巨噬细胞重编程为抗炎表型(CD206+表型),从而通过调控TGF-β/Smad2/3信号通路抑制EMT起到治疗IPF的作用。这个结果也从侧面揭示了HIF-1α/HO-1信号通路调控巨噬细胞抗炎表型重编程是间质性肺纤维化发生发展的机制之一。同时该团队证实了CO作为SMA/CORM2的效应分子发挥对IPF的保护作用。此外,在肝肾功能和肺组织层面验证了SMA/CORM2的安全性。因此该团队认为纳米缓释型CO供体SMA/CORM2具有治疗间质性肺纤维化的作用(图5)。
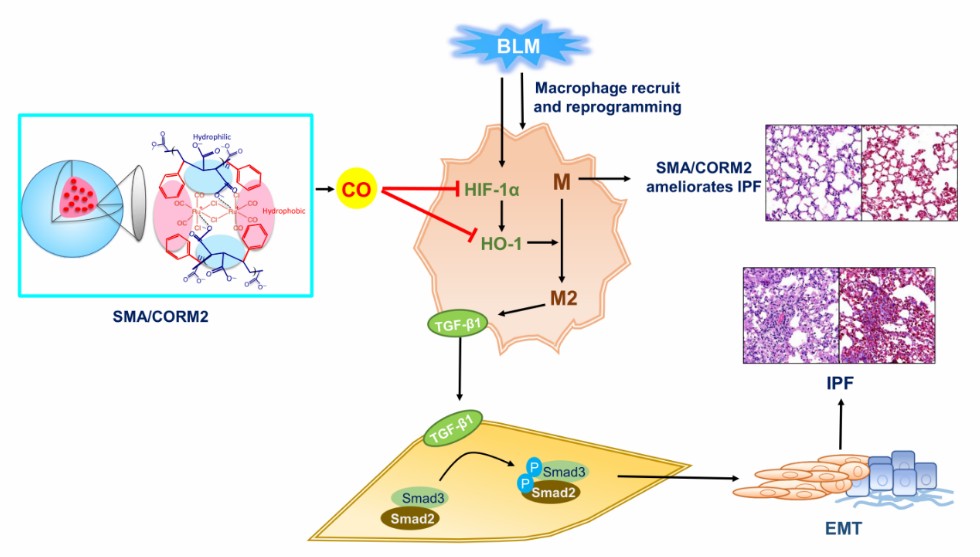
图5. SMA/CORM2治疗IPF的机制概要
本研究的亮点总结:
1. CO通过HIF-1α/HO-1信号通路调控巨噬细胞重编程;
2. 巨噬细胞重编程是治疗IPF的靶点;
3. 纳米缓释型CO供体SMA/CORM2具有靶向治疗IPF的作用。
【文章信息】
Volume 341, January 2022, Pages 566-577
https://doi.org/10.1016/j.jconrel.2021.11.047
【作者信息】
通讯作者:方军
日本崇城大学(Sojo University)药学部副教授,安徽医科大学海外特聘教授。长期从事肿瘤靶向性高分子药物(肿瘤治疗和显像)的开发,及活性氧/炎症机制和药物的相关研究。从2014年起连续4年入选THOMSON REUTERS/Clarivate Analytics的Highly Cited Researchers(药理学与毒理学领域,Pharmacology & Toxicology)。日本药物送达(DDS)学会评议员、World Journal of Pharmacology(WJP)编委、Journal of Clinical Oncology & Research编委、药物控制释放(CRS)学会会员、日本药物送达(DDS)学会会员、日本癌学会会员和日本药学会会员。Biomaterials,J Control Release,Cancer Res,Cancer Sci等国际SCI期刊审稿人。
张诗晨
安徽医科大学公共卫生学院,副教授。
第一作者:郭春玉
安徽医科大学公共卫生学院卫生毒理学专业,硕士研究生。
张程
安徽医科大学公共卫生学院,副教授。
【参考资料】
[1] Wang, L. Q., Li, S., Yao, Y. Q., Yin, W. Y., Ye, T. H. The role of natural products in the prevention and treatment of pulmonary fibrosis: a review. Food & Function 2021. 12 (3): 990-1007. https://doi.org/10.1039/d0fo03001e.
[2] Kolahian, S., Fernandez, I. E., Eickelberg, O., Hartl, D. Immune Mechanisms in Pulmonary Fibrosis. Am J Respir Cell Mol Biol 2016. 55 (3): 309-322. https://doi.org/10.1165/rcmb.2016-0121TR.
[3] Yin, H. Z., Fang, J., Liao, L., Nakamura, H., Maeda, H. Styrene-maleic acid copolymer-encapsulated CORM2, a water-soluble carbon monoxide (CO) donor with a constant CO-releasing property, exhibits therapeutic potential for inflammatory bowel disease. Journal of Controlled Release 2014. 187 14-21. https://doi.org/10.1016/j.jconrel.2014.05.018.
[4] Song, B., Zhang, C., Hu, W., Guo, C., Xia, Z., Hu, W., Qin, M., Jiang, W., Lv, J., Xu, D., Zhang, S., Fang, J. Nano-designed carbon monoxide donor SMA/CORM2 exhibits protective effect against acetaminophen induced liver injury through macrophage reprograming and promoting liver regeneration. J Control Release 2021. 331 350-363. https://doi.org/10.1016/j.jconrel.2021.01.025.
[5] Wang, J., Xu, L., Xiang, Z., Ren, Y., Zheng, X., Zhao, Q., Zhou, Q., Zhou, Y., Xu, L., Wang, Y. Microcystin-LR ameliorates pulmonary fibrosis via modulating CD206(+) M2-like macrophage polarization. Cell Death Dis 2020. 11 (2): 136. https://doi.org/10.1038/s41419-020-2329-z.
[6] Naito, Y., Takagi, T., Higashimura, Y. Heme oxygenase-1 and anti-inflammatory M2 macrophages. Arch Biochem Biophys 2014. 564 83-88. https://doi.org/10.1016/j.abb.2014.09.005.
[7] Medina, M. V., Sapochnik, D., Garcia Sola, M., Coso, O. Regulation of the Expression of Heme Oxygenase-1: Signal Transduction, Gene Promoter Activation, and Beyond. Antioxid Redox Signal 2020. 32 (14): 1033-1044. https://doi.org/10.1089/ars.2019.7991.
文/郭春玉
